Научная группа профессора И.А. Баловой
Научная группа кафедры органической химии
Лаборатории: 4072, 4073, 4076, 4083
Химия ацетиленовых соединений
Состав группы
Руководитель
 |
Ирина Анатольевна Баловад.х.н, директор Института химии |
Сотрудники
 |
Говди Анастасия Иосифовнак.х.н., доцент |
 |
Данилкина Наталья Александровнак.х.н., доцент |
 |
Ефремова Мария Михайловнак.х.н., доцент кабинеты: 4128, 4124 |
 |
Сорокоумов Виктор Николаевичк.х.н., доцент председатель Учебно-Методической комиссии Института химии |
Студенты и аспиранты (кафедра органической химии)
 |
Видякина Александра Александровна3 курс аспирантуры |
 |
Хмелевская Екатерина Алексеевна4 курс аспирантуры |
 |
Диденко Егор Александрович1 курс аспиратнуры |
 |
Ким Миа Деновна1 курс магистратуры |
 |
Огурцова Анна Дмитриевна2 курс магистратуры |
 |
Галкин Егор Сергеевич4 курс бакалавриата |
 |
Власова Елена Евгеньевна2 курс бакалавриата |
 |
Вотчель Елена РомановнаБакалавриат 2 курс |
 |
Крюкова Полина Игоревна2 курс бакалавриата |
 |
Менчиков Василий Владиславович3 курс бакалавриата |
 |
Парфенюк Анна ДмитриевнаБакалавриат 2 курс |
 |
Хашимова Диана Давлатовна3 курс бакалавриата |
 |
Мельников Владимир Евгеньевич2 курс бакалавриата |
Шонин Георгий1 курс бакалавриата |
Тематика группы
- Разработка подходов к синтезу фунцкционализированных моно- и диацетиленовых соединений.
- Применение ацетиленовых соединений в синтезе гетероциклов.
- Разработка методов получения аналогов ендииновых антибиотиков и изучение их химических и биологических свойств.
- Разработка подходов к синтезу напряженных циклоалкинов как реагентов для click-реакций и биоортогональной химии.
- Получение и изучение свойств новых каталитических систем на основе диаминокарбеновых комплексов палладия в реакциях Соногаширы-Хагихары, Сузуки-Мияуры, Бухвальда-Хартвига.
- Синтез новых флуоресцирующих полиариленэтиниленовых полимеров, изучение их свойств и области применения.
Основные научные направления
Направление 1 — Ацетиленовые соединения в органическом синтезе и создании на их основе веществ с полезными свойствами
(A) Разработка подходов к синтезу фунцкционализированных диацетиленовых соединений
Среди методов получения терминальных диинов особое место занимает реакция «диацетиленовой молнии» [A] — открытый в нашей научной группе уникальный процесс одновременного перемещения двух сопряженных тройных связей из интернального положения в терминальное под действие 2-аминоэтанамида лития. Данная реакция может быть использована как для нефункционализированных алкадиинов, так и в ряду диацетиленовых спиртов. [B] [1]
«Диацетиленовая молния» с последующей функционализацией была успешно применена в синтезе кетонов, [2] диацетиленовых спиртов, [C] [D] карбоновых кислот [D], тетраинов [E] и других производных.
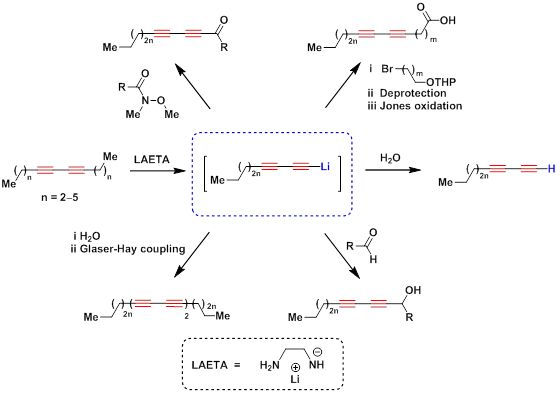
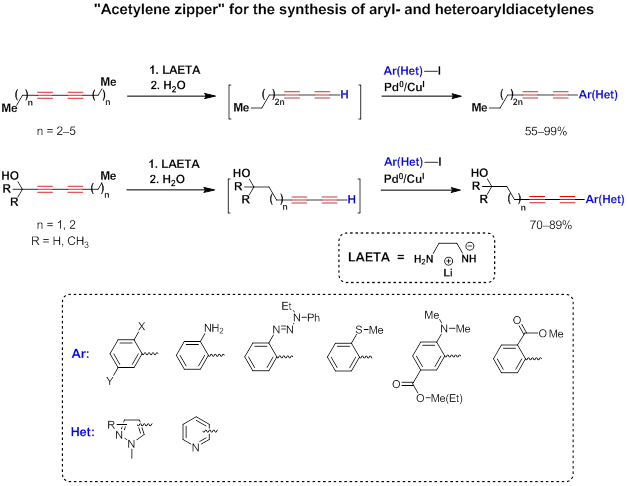
В тандеме с реакцией Соногаширы, [3][4][5][6][1][7][8] диацетиленовая молния является уникальным синтетическим методом для получения арил- и гетероарилдиацетиленов.
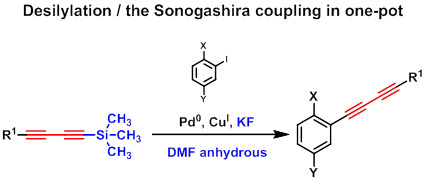
Вторым методом получения терминальной диацетиленовой функции является удаление защитных групп. Наиболее мягкие условия используются для удаления триметилсилильной (ТМС) защитной группы. Десилилирование ТМС-диацетиленов под действием KF и реакция Соногаширы в условиях one-pot оказались удобным методом получения функционализированных аренов, содержащих диацетиленовый фрагмент.[9]
(B) Диацетиленовые соединения в синтезе гетероциклов
Две сопряженные тройные связи наделены поистине безграничным синтетическим потенциалом. Исследования, проводимые в нашей группе, показали, что арилдиацетилены, содержащие в орто-положении к тройным связям гетероатомную функциональную группу, способны претерпевать гетероциклизации с участием лишь одной тройной связи (электрофил промотируемую циклизацию,[10][11][12] циклизацию Рихтера [13][14][5]), давая гетероциклы, содержащие и тройную связь, и атом галогена при соседних атомах углерода. Данный способ был впервые использован в нашей группе для получения синтетически важных иодэтинилбензотиофенов, -бензофуранов, -индолов, -изокумаринов и бромэтинилциннолинов. Кроме этого, недавно нами было установлено, что медь-катализируемое азид-алкиновое циклоприсоединение (CuAAC) 1-иодбута-1,3-диинов к органическим азидами является эффективным методом получения 5-иод-4-этинил[1,2,3]триазолов. [15]
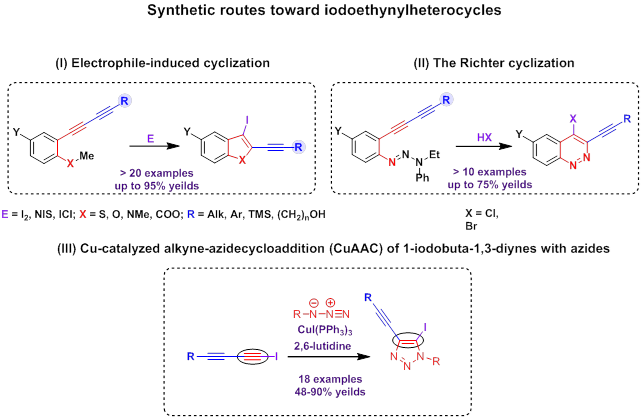
Обе функциональные группы (тройная связь и атом галогена) чрезвычайно важны для дальнейшей функционализации гетероциклических молекул. Все три метода синтеза иодэтинилгетероциклов легли в основу предложенной в нашей группе стратегии синтеза гетероциклических аналогов природных ендииновых антибиотиков.
(С) Синтез и свойства аналогов ендииновых антибиотиков
Ендииновые антибиотики — соединения, обладающие высокой противоопухолевой и антибактериальной активности благодаря способности (Z)-3-ен-1,5-дииновой системы, включенной в 9- или 10-членный цикл, претерпевать циклоароматизацию Бергмана с образованием 1,4-фенилендирадикалов, разрушающих молекулы ДНК.
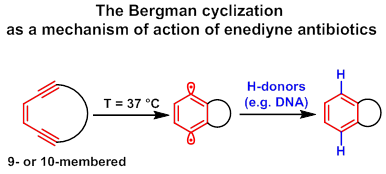
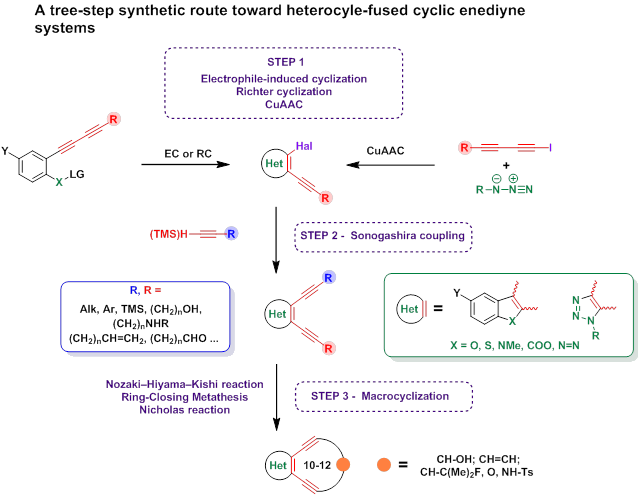
В нашей группе ведется поиск простейших аналогов природных ендииновых антибиотиков, аннелированных с гетероциклами. Разработанный нами способ синтеза иодоэтинилгетероциклов при комбинации с реакцией Соногаширы позволяет вводить в соседние положения гетероцикла ацетиленовые фрагменты с четко заданными функциональными группами. В свою очередь, это открывает возможность синтеза нужных исходных соединений для макроциклических ендииновых систем, в зависимости от того, какой метод макроциклизации будет выбран. Для синтеза ендиинов нами изучены границы применения макроциклизации при помощи макроциклизации по Нозаки,[16][17] метатезиса алкенов,[11] [18] и реакции Николаса.[19][20][21]
На сегодняшний день реакция Николаса оказалась наиболее универсальной для этих целей и позволила верифицировать шкалу относительной реакционной способности ендиинов, конденсированных с бензотиофеном.[20]
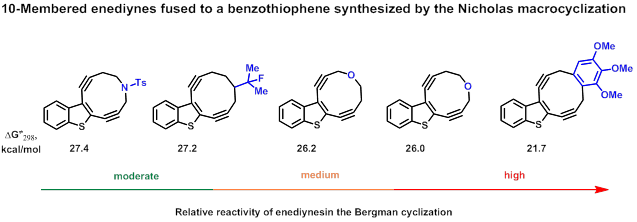
При сотрудничестве с кафедрой генетики и биотехнологии биологического факультета СПбГУ нами было установлено, что 10-членные ендиины способны генерировать 1- и 2-цепочечные разрывы ДНК, что крайне важно для поиска в этом ряду новых противоопухолевых соединений.
В настоящее время в группе проводятся работы по синтезу небольшой базы 10-членных ендиинов, конденсированных с различным гетероциклами.
Синтез новых флуоресцирующих полиариленэтиниленовых полимеров
Сегодня полиариленэтинилены являются перспективной группой для создания полимеров с четко заданными свойствами. Так, для полиариленэтиниленов, в структуре которых имеются группы, способные избирательно связываться с аналитами, после связывания с аналитом наблюдается эффект гашения флуоресценции. Такие полимеры интересны для создания детекторных систем. В нашей группе были получены полиариленэтинилены, содержащие циннолиновые фрагменты, способные проявлять эффект гашения флуоресценции в присутствии ионов PdII.[22] Планируется создание полиариленэтиниленов, содержащих бензотиофеновые и триазольные фрагменты.
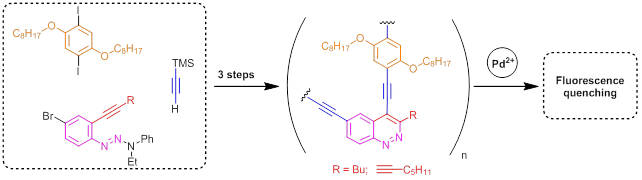
Направление 2 — Новые катализаторы и их использование в синтезе ацетиленовых соединений
Для эффективного осуществления «атом-экономичных» превращений при создании новых углерод-углеродных и углерод-гетероатомных связей в ряду производных ацетилена и органических соединений других классов в нашей группе ведутся исследования по разработке эффективных гомогенных и гетерогенных каталитических систем.
В работе можно выделить два взаимозависимых направления:
- исследование высокоактивных гомогенных катализаторов на основе диаминокарбеновых комплексов палладия, способных эффективно работать в условиях низких каталитических концентраций;
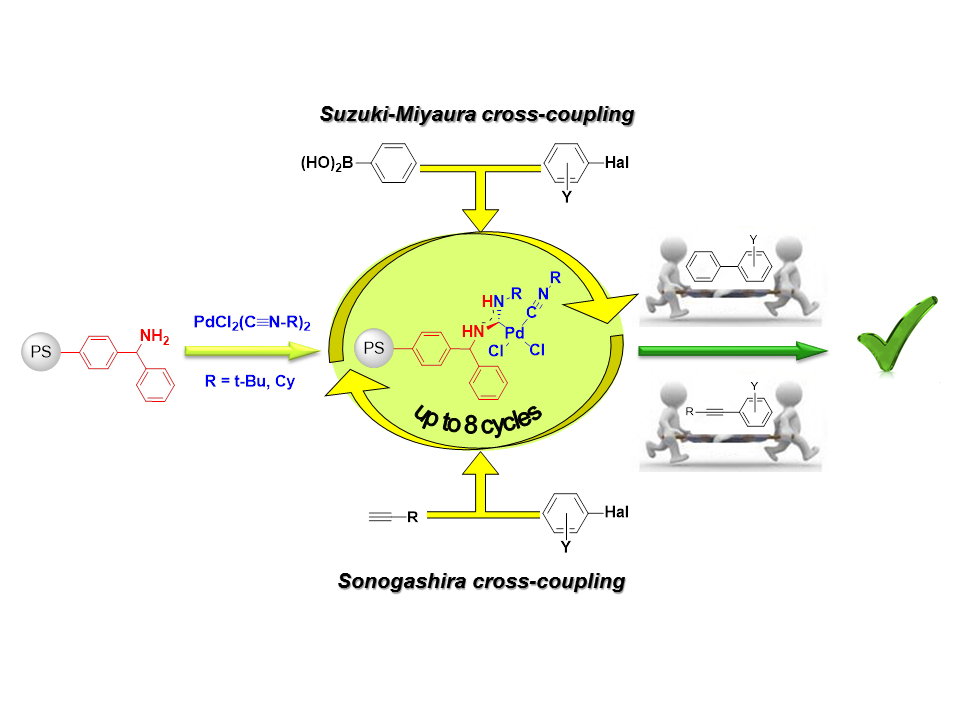
- развитие регенерируемых катализаторов путем иммобилизации высокоактивных гомогенных комплексов палладия на подходящем носителе,[23] который инертен в используемых условиях реакции.
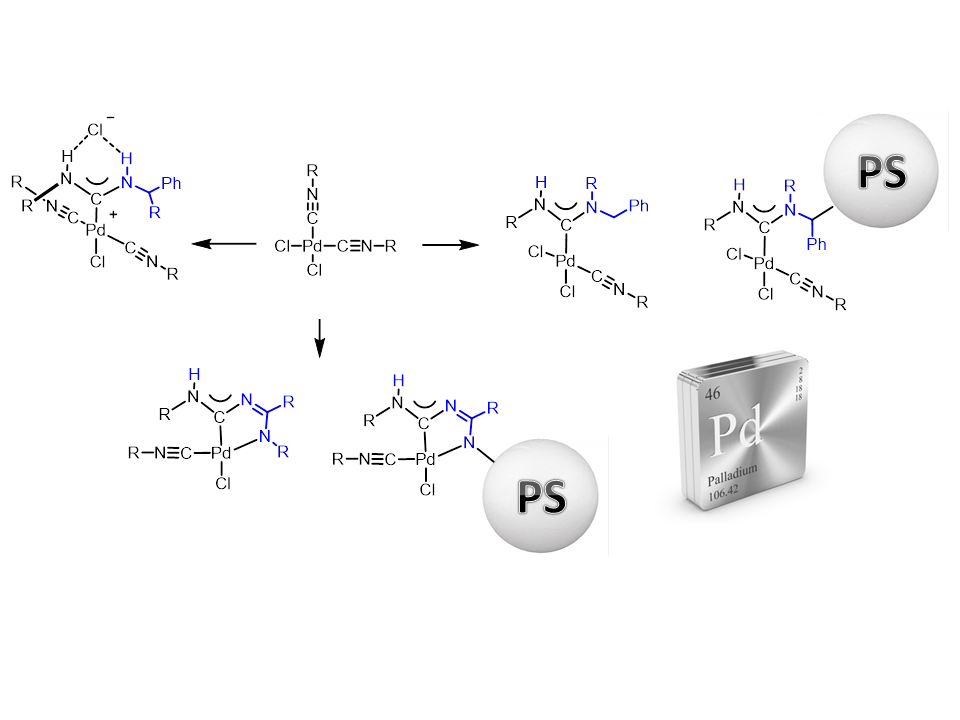
В настоящее время с помощью металл-промотируемой реакции нуклеофильного присоединения амино- и амидиновых групп к изоцианидам в составе комплексов палладия (II) разработан метод получения эффективных гетерогенных каталитических систем на основе ациклических диаминокарбеновых комплексов палладия,[24] проявляющих высокую активность в условиях реакций Соногаширы и Сузуки на широком наборе субстратов, с возможностью многократного использования каталитических систем без существенной потери каталитической активности.
В рамках проводимого нами исследования было показано,[25] что основной вклад в каталитическую активность гетерогенных прекатализаторов на основе ациклических диаминокарбеновых комплексов палладия вносит палладий, обратимо вымываемый в раствор с носителя в процессе реакции за счет нового пути активации PdII – Pd0 через образование карбодиимида.

Наши результаты показывают принципиально новый путь генерации и стабилизации Pd0-видов и проливают свет на характер катализа для комплексов палладия с различными диаминокарбеновыми лигандами. Легкость удаления карбодиимида и HCl с образованием каталитически активного Pd0 из разработанных прекатализаторов может стать хорошей альтернативой активации коммерчески доступных прекатализаторов Бухвальда.
В научной группе также ведутся разработки перспективных каталитических систем, способных катализировать реакции с участием малореакционоспособных коммерчески важных арилхлоридов в мягких условиях (при комнатной температуре без использования сильных оснований).
Направление 3 — Разработка новых ингибиторов протеинфосфотирозинфосфатазы 1В на основе производных 4-оксо-1,4-дигидроциннолина
Фермент протеинфосфотирозинфосфатаза 1В (ПФТФ1В) является важнейшим негативным регулятором инсулиновой и лептиновой систем, которые активируются через тирозинкиназные механизмы. Повышение активности ПФТФ1В ведет к инсулиновой (ИР) и лептиновой резистентности (ЛР) и является причиной ожирения, сахарного диабета и других метаболических расстройств. В связи с этим актуальной задачей эндокринологии является расшифровка механизмов действия ПФТФ1В с помощью функциональных зондов и разработка ее селективных ингибиторов, применение которых является многообещающим подходом для лечения метаболических расстройств, связанных с ИР и ЛР. Наиболее перспективным направлением в разработке ингибиторов ПФТФ1В является создание «бинарных» ингибиторов, которые взаимодействуют с каталитическим (низкоспецифичным) и аллостерическим (высокоспецифичным) сайтами ПФТФ1В, что обеспечивает высокую эффективность и селективность их действия.
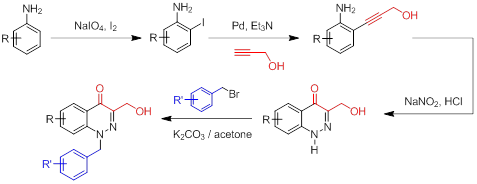
Нами было предложено использовать производные 4-оксо-1,4-дигидроциннолина как специфичные ингибиторы ПФТФ1В. Разработанный подход к синтезу с использованием реакции Соногаширы для получения орто-этинилзамещенных анилинов и реакция Рихтера для формирования циннолинового ядра, позволяет получать подобные производные с хорошими выходами за малое число стадий. Кроме того, были получены предварительные результаты [26] об эффективности впервые синтезированного производного 4-оксо-1,4-дигидроциннолина – этилового эфира 3-(гидроксиметил)-4-оксо-1,4-дигидроциннолин-6-карбоновой кислоты как специфичного ингибитора ПФТФ1В в условиях in vitro и in vivo. Было показано, что при обработке первичной культуры гипоталамических нейронов крысы с помощью этилового эфира 3-(гидроксиметил)-4-оксо-1,4-дигидроциннолин-6-карбоновой кислоты происходит усиление стимулирующего эффекта лептина на фосфорилирование Akt-киназы и STAT3-белка, что свидетельствует о подавлении активности ПФТФ1В, которая негативно регулирует эффекты лептина. Наряду с этим, это производное 4-оксо-1,4-дигидроциннолина при курсовом введении крысам вызывало снижение аппетита, массы тела, жировой ткани, улучшало метаболические показатели и повышало чувствительность к инсулину у крыс с экспериментальной моделью ожирения.
Литература
- Балова И. А., Ремизова Л.А., Фаворская И.А. Прототропная изомеризация диацетиленовых соединений. ЖОрХ, 1986, 22 (11) 2459−2460.
- И.А.Балова, И.В.Захарова, Л. А. Ремизова. Прототропная изомеризация диацетиленовых спиртов. ЖОрХ, 1993, 29(9), 1732-1738.
- Балова И. А., Морозкина С. Н., Воскресенский С. В., Ремизова Л. А. Последовательные реакции диацетиленов: «ацетиленовая молния» и оксиалкилирование 1-литио-1,3-диинов как путь синтеза α- и β- диацетиленовых спиртов. ЖОрХ , 2000, 36 (10), 1466.
- И.А. Балова, Л.А. Ремизова, В.Ф. Макарычева, Е.Г. Румянцева, И.А. Фаворская. Синтез длинноцепных диацетиленовых спиртов. ЖОрХ, 1991, 27 (1), 64-66.
- И.А.Балова, Л. А. Ремизова. Реакция ацетиленовой молнии диацетиленовых соединений в синтезе тетраинов. ЖОрХ, 1994, 30 (2), 207-9.
- Kulyashova, A.E.; Sorokoumov, V.N.; Popik, V. V; Balova, I.A. An acetylene zipper—Sonogashira reaction sequence for the efficient synthesis of conjugated arylalkadiynols. Tetrahedron Lett. 2013, 54, 2235–2238, https://linkinghub.elsevier.com/retrieve/pii/S004040391300316X
- Novikov, R. V; Vasil’ev, A.A.; Balova, I.A. Convenient synthesis of dodeca-1,3-diynyl ketones by the “diacetylene zipper” reaction. Russ. Chem. Bull. 2005, 54, 1043–1045, http://link.springer.com/10.1007/s11172-005-0355-8
- Balova, I.A.; Morozkina, S.N.; Knight, D.W.; Vasilevsky, S.F. A one-pot synthesis of 1-arylalka-1,3-diynes by sequential acetylene zipper and Sonogashira reactions. Tetrahedron Lett. 2003, 44, 107–109, http://linkinghub.elsevier.com/retrieve/pii/S0040403902024966
- Balova, I.A.; Sorokoumov, V.N.; Morozkina, S.N.; Vinogradova, O. V; Knight, D.W.; Vasilevsky, S.F. A Convenient Synthesis of Functionalised 1-Aryl-1,3-alkadiynes. Eur. J. Org. Chem. 2005, 2005, 882–888, http://doi.wiley.com/10.1002/ejoc.200400688
- Vinogradova, O. V.; Sorokoumov, V.N.; Balova, I.A. A short route to 3-alkynyl-4-bromo(chloro)cinnolines by Richter-type cyclization of ortho-(dodeca-1,3-diynyl)aryltriaz-1-enes. Tetrahedron Lett. 2009, 50, 6358–6360, http://dx.doi.org/10.1016/j.tetlet.2009.08.103
- Sorokoumov, V.N.; Popik, V. V.; Balova, I.A. Access to 2,3-bis(buta-1,3-diynyl)pyridines. Mendeleev Commun. 2011, 21, 19–20, https://linkinghub.elsevier.com/retrieve/pii/S0959943611000095
- Govdi, A.I.; Kulyashova, A.E.; Vasilevsky, S.F.; Balova, I.A. Functionalized buta-1,3-diynyl- N -methylpyrazoles by sequential “diacetylene zipper” and Sonogashira coupling reactions. Tetrahedron Lett. 2017, 58, 762–765, http://dx.doi.org/10.1016/j.tetlet.2017.01.032
- Kulyashova, A.E.; Mikheeva, E. V.; Danilkina, N.A.; Balova, I.A. Synthesis of 2-(buta-1,3-diynyl)-N,N-dimethylanilines Using Reductive Methylation Step. Mendeleev Commun. 2014, 24, 102–104, http://dx.doi.org/10.1016/j.mencom.2014.03.013
- Lyapunova, A.G.; D’yachenko, A.S.; Danilkina, N.A. Potassium fluoride for one-pot desilylation and the Sonogashira coupling of ethynylsilanes and buta-1,3-diynylsilanes. Russ. J. Org. Chem. 2017, 53, 800–804, http://link.springer.com/10.1134/S1070428017050268
- Danilkina, N.; Bräse, S.; Balova, I. Electrophilic Cyclization of Buta-1,3-diynylarenes: Synthesis of Precursors of (Z)-3-Ene-1,5-diyne Systems Fused to Heterocycles. Synlett 2011, 2011, 517–520, http://www.thieme-connect.de/DOI/DOI?10.1055/s-0030-1259547
- Danilkina, N.A.; Kulyashova, A.E.; Khlebnikov, A.F.; Bräse, S.; Balova, I.A. Electrophilic Cyclization of Aryldiacetylenes in the Synthesis of Functionalized Enediynes Fused to a Heterocyclic Core. J. Org. Chem. 2014, 79, 9018–9045, http://pubs.acs.org/doi/10.1021/jo501396s
- Danilkina, N.A.; Gurskaya, L.Y.; Vasilyev, A. V.; Balova, I.A. Towards Isocoumarin-Fused Enediyne Systems through the Electrophilic Cyclization of Methyl o -(Buta-1,3-diynyl)benzoates. Eur. J. Org. Chem. 2016, 2016, 739–747, http://doi.wiley.com/10.1002/ejoc.201501262
- Vinogradova, O. V.; Sorokoumov, V.N.; Vasilevsky, S.F.; Balova, I.A. The Richter reaction of ortho-(alka-1,3-diynyl)aryldiazonium salts. Tetrahedron Lett. 2007, 48, 4907–4909, https://linkinghub.elsevier.com/retrieve/pii/S0040403907009203
- Vinogradova, O. V.; Sorokoumov, V.N.; Vasilevskii, S.F.; Balova, I.A. Studies on cyclization of o-(alka-1,3-diynyl)arenediazonium salts. Russ. Chem. Bull. 2008, 57, 1725–1733, http://link.springer.com/article/10.1007/s11172-008-0228-z
- Govdi, A.I.; Danilkina, N.A.; Ponomarev, A. V.; Balova, I.A. 1-Iodobuta-1,3-diynes in Copper-Catalyzed Azide–Alkyne Cycloaddition: A One-Step Route to 4-Ethynyl-5-iodo-1,2,3-triazoles. J. Org. Chem. 2019, 84, 1925–1940, http://pubs.acs.org/doi/10.1021/acs.joc.8b02916
- Kulyashova, A.E.; Ponomarev, A.V.; Selivanov, S.I.; Khlebnikov, A.F.; Popik, V.V.; Balova, I.A. Cr(II)-promoted internal cyclization of acyclic enediynes fused to benzo[ b ]thiophene core: Macrocycles versus 2-methylenecycloalkan-1-ols formation. Arab. J. Chem. 2018, https://doi.org/10.1016/j.arabjc.2018.05.005
- Vinogradova, O. V.; Balova, I.A.; Popik, V. V. Synthesis and Reactivity of Cinnoline-Fused Cyclic Enediyne. J. Org. Chem. 2011, 76, 6937–6941, http://pubs.acs.org/doi/abs/10.1021/jo201148h
- Danilkina, N.; Nieger, M.; Selivanov, S.; Bräse, S.; Balova, I. Electrophilic Cyclization and Ring-Closing Metathesis as Key Steps in the Synthesis of a 12-Membered Cyclic Enediyne. Eur. J. Org. Chem. 2012, 2012, 5660–5664, http://doi.wiley.com/10.1002/ejoc.201200881
- Lyapunova, A.G.; Danilkina, N.A.; Khlebnikov, A.F.; Köberle, B.; Bräse, S.; Balova, I.A. Oxaenediynes through the Nicholas-Type Macrocyclization Approach. Eur. J. Org. Chem. 2016, 2016, 4842–4851, http://doi.wiley.com/10.1002/ejoc.201600767
- Lyapunova, A.G.; Danilkina, N.A.; Rumyantsev, A.M.; Khlebnikov, A.F.; Chislov, M. V.; Starova, G.L.; Sambuk, E. V.; Govdi, A.I.; Bräse, S.; Balova, I.A. Relative Reactivity of Benzothiophene-Fused Enediynes in the Bergman Cyclization. J. Org. Chem. 2018, 83, 2788–2801, http://pubs.acs.org/doi/10.1021/acs.joc.7b03258
- Danilkina, N.; Rumyantsev, A.; Lyapunova, A.; D’yachenko, A.; Khlebnikov, A.; Balova, I. 10-Membered Azaenediyne Fused to a Benzothiophene through the Nicholas Macrocyclization: Synthesis and DNA Cleavage Ability. Synlett 2019, 30, 161–166, http://www.thieme-connect.de/DOI/DOI?10.1055/s-0037-1610352
- Danilkina, N.A.; Vlasov, P.S.; Vodianik, S.M.; Kruchinin, A.A.; Vlasov, Y.G.; Balova, I.A. Synthesis and chemosensing properties of cinnoline-containing poly(arylene ethynylene)s. Beilstein J. Org. Chem. 2015, 11, 373–384, http://www.beilstein-journals.org/bjoc/content/11/1/43
- Mikhaylov, V.N.; Sorokoumov, V.N.; Balova, I.A. Polystyrene-supported diaminocarbene complexes of palladium(II): synthesis, characterization and application as a precatalyst in Sonogashira–Hagihara and Suzuki–Miyaura cross coupling. Russ. Chem. Rev. 2017, 86, 459–473, http://stacks.iop.org/0036-021X/86/i=6/a=459?key=crossref.3ea2445ecd754502db2a71e84887b220
- Mikhaylov, V.N.; Sorokoumov, V.N.; Korvinson, K.A.; Novikov, A.S.; Balova, I.A. Synthesis and Simple Immobilization of Palladium(II) Acyclic Diaminocarbene Complexes on Polystyrene Support as Efficient Catalysts for Sonogashira and Suzuki–Miyaura Cross-Coupling. Organometallics 2016, 35, 1684–1697, https://pubs.acs.org/doi/10.1021/acs.organomet.6b00144
- Mikhaylov, V.; Sorokoumov, V.; Liakhov, D.; Tskhovrebov, A.; Balova, I. Polystyrene-Supported Acyclic Diaminocarbene Palladium Complexes in Sonogashira Cross-Coupling: Stability vs. Catalytic Activity. Catalysts 2018, 8, 141, http://www.mdpi.com/2073-4344/8/4/141
- Zakharova, I.O.; Sorokoumov, V.N.; Bayunova, L. V; Derkach, K. V; Shpakov, A.O. 4-oxo-1,4-dihydrocinnoline Derivative with Phosphatase 1B Inhibitor Activity Enhances Leptin Signal Transduction in Hypothalamic Neurons. J. Evol. Biochem. Physiol. 2018, 54, 273–280, http://link.springer.com/10.1134/S0022093018040038
Публикации
2024
- N. V. Rostovskii, A. S. Pankova, I. A. Balova. (Chapter in a review) Organic Chemistry in Russian Universities. Achievements of Recent Years I. I. Stoikov, I. S. Antipin, V. A. Burilov et al. Russian Journal of Organic Chemistry, 2024, Vol. 60, No. 8, pp. 1361–1584. DOI: 10.1134/S1070428024080013
- N. A. Danilkina, Ekaterina A. Khmelevskaya, Andrey A. Shtyrov, Mikhail N. Ryazantsev, Alexander F. Khlebnikov, Elena Yu. Tupikina, Andrey M. Rumyantsev, Alexander S. D'yachenko, Irina A. Balova. Filling the Gap within 10-Membered Heteroenediynes: Thiaenediyne – An Experimental and Theoretical Study. Eur. J. Org. Chem. 2024, 27 (47), e202401127. https://doi.org/10.1002/ejoc.202401127
- A. A. Vidyakina, S. A. Silonov, A. I. Govdi, A.Yu. Ivanov, E.P. Podolskaya, I. A. Balova, S. Bräse, N. A. Danilkina. Key role of cycloalkyne nature in alkyne-dye reagents for enhanced specificity of intracellular imaging by bioorthogonal bioconjugation. Org. Biomol. Chem., 2024, 22, 7637-7642, https://doi.org/10.1039/D4OB01032A
- A. V. Ponomarev, N. A. Danilkina, J. S. Okuneva, A. A. Vidyakina, E. A. Khmelevskaya, A. S. Bunev, A. M. Rumyantsev, A. I Govdi, T. Suarez, I. V. Alabugin, I. A Balova. Facile synthesis of diiodoheteroindenes and understanding their Sonogashira cross-coupling selectivity for the construction of unsymmetrical enediynes. Org. Biomol. Chem., 2024, 22, 4096-4107, https://doi.org/10.1039/D4OB00530A
- M. A. Gureev, N. A. Danilkina, A. F. Khlebnikov, I. A. Balova. Docking and Molecular Dynamics Studies on DNA-Heterocyclic Enediynes Interaction to Identify the Preferred Binding Mode. Russ. J. Gen. Chem. 2024, 94, 100-119, https://doi.org/10.1134/S1070363224140111
- I.A. Balova, N. A. Danilkina, A. I. Govdi. The chemistry of heterocycles in the 21st century (глава в обзоре). Russian Chemical Reviews, 2024, 93, RCR5125. DOI: 10.59761/RCR5125
- Cu-catalyzed cycloaddition of aryl azides to 1-iodobuta-1,3-diynes: an experimental and quantum chemical study of unusual regiochemistry. A. I. Govdi, N. A. Danilkina, A. A. Shtyrov, M. N. Ryazantsev, M. D. Kim, M. A. Kryukova, I. A. Balova. New J. Chem., 2024, 48, 4831-4845, https://doi.org/10.1039/D3NJ03823H
- Derkach, K.V., Sorokoumov, V.N., Morina, I.Y. et al. Regulatory Effects of 5-Day Oral and Intraperitoneal Administration of a Thienopyrimidine Derivative on the Thyroid Status in Rats. Bull Exp Biol Med, 177, 559–563 (2024). doi: 10.1007/s10517-024-06223-8
- Деркач К.В., Бахтюков А.А., Сорокоумов В.Н., Лебедев И.А., Диденко Е.А., Шпаков А.О. Низкомолекулярный инверсионный агонист рецептора тиреотропина активен как при внутрибрюшинном, так и при пероральном введении // Российский физиологический журнал им. И.М. Сеченова. - 2024. - Т. 110. - № 1. - C. 108-121. doi: 10.31857/S0869813924010078
- Derkach K.V., Bakhtyukov A.A., Sorokoumov V.N., Didenko E.A., Romanova I.V., Morina I.Y., Lebedev I.A., Bayunova L.V., Shpakov A.O. Dynamics of gonadotropin and thienopyrimidine derivative TP03 effects on ovulation and ovarian steroidogenesis in Follimag-stimulated immature female rats // Reviews on Clinical Pharmacology and Drug Therapy. - 2024. - Vol. 22. - N. 1. - P. 53-65. doi: 10.17816/RCF622883
- Derkach, K.V., Bakhtyukov, A.A., Sorokoumov, V.N. et al. Low Molecular Weight Thyrotropin Receptor Inverse Agonist Is Active upon Both Intraperitoneal and Oral Administration. J Evol Biochem Phys, 60, 295–305 (2024). doi: 10.1134/S0022093024010216
- Meshalkin S.A. , Tsybulin S.V., Bardakov V.G., Tatarinov I.A., Shitov D.A., Tupikina E.Y., Efremova M.M., Antonov A.S. “Buttressing Effect” in the Halogen-Lithium Exchange in ortho-Bromo-N,N-dimethylanilines and Related Naphthalenes, Chem. Eur. J. 2024, e202303956. DOI: 10.1002/chem.202303956
- Efremova M.M., Ivanov A.V., Panikorovskii T.L., Molchanov A.P. Reactions of 1-Vinyl-4,5-dihydro-1H-benzo[g]indole with Nitrones in Presence of Nickel(II) Perchlorate, Russ. J. Gen. Chem., 2024, 94, S53–S59. DOI: 10.1134/S1070363224140081
- Efremova a M.M., Khashimova D.D., Kalinin N.S., Shtyrov A.A., Ryazantsev M.N., Spiridonova D.V., Govdi A.I., Balova I.A. Microwave assisted cycloaddition of benzonitrile oxides to 1-iodobuta-1,3-diynes, Mendeleev Communications, 2024, 34, 536-539. DOI: 10.1016/j.mencom.2024.06.022
- А. И. Говди, К. В. Кимеле, И. А. Балова. Изучение иод-промотируемой циклизации 4,5-диэтинил-1,2,3-триазолов для синтеза триазол-иодгетероциклических диад. Известия Академии наук. Серия химическая, 2024, том 73, № 11 (в печати)
2023
- A.A. Vidyakina, A. A. Shtyrov, M.N. Ryazantsev, A. F. Khlebnikov, I. E. Kolesnikov, V. V. Sharoyko. D. V. Spiridonova, I. A. Balova, S. Bräse, N. A. Danilkina. Development of Fluorescent Isocoumarin-Fused Oxacyclononyne – 1,2,3-Triazole Pairs. Chemistry — A European Journal, 2023, e202300540. Статья находится в открытом доступе и попала в Hot Topic: Click Chemistry издательства Wiley: 10.1002/(ISSN)1521-3773.hottopic-clickchemistry.
- A. A. Babushkina, V. N. Mikhailov. A. D. Ogurtsova, A. S. Bunev, V.N. Sorokoumov, I. A. Balova. The Richter reaction in the synthesis of combretastatin analogs. Russian Chemical Bulletin. 2023, 72(4), 1012-1022. DOI: 10.1007/s11172-023-3866-3.
- A. I. Govdi, S. O. Anisimov, N. A. Danilkina, A. S. Bunev. I. A. Balova. Acyclic enediynes fused to triazoleand benzothiophene containing propargylamine moieties. Mendeleev Commun., 2023, 33, 328–330. DOI: 10.1016/j.mencom.2023.04.010.
- K. V. Derkach, M. A. Gureev, A. A. Babushkina, V. N. Mikhaylov , I. O. Zakharova, A. A. Bakhtyukov, V. N. Sorokoumov, A. S. Novikov, M. Krasavin, A. O. Shpakov, I. A. Balova. Dual PTP1B/TC-PTP Inhibitors: Biological Evaluation of 3-(Hydroxymethyl)cinnoline-4(1H)-Ones, Int. J. Mol. Sci. 2023, 24(5), 4498; DOI: 10.3390/ijms24054498.
- Bakhtyukov A.A., Derkach K.V., Fokina E.A. , Lebedev I.A., Sorokoumov V.N., Bayunova, L.V., Shpakov A.O., / Effect of Different Luteinizing Hormone Receptor Agonists on Ovarian Steroidogenesis in Mature Female Rats. / J Evol Biochem Phys 59, 57–68 (2023). DOI: 10.1134/S0022093023010052.
- Fokina E.A., Derkach K.V., Bakhtuykov A.A., Sorokoumov V.N., Lebedev I.A., Morina I.Y., Shpakov A.O. / Stimulation Of Ovulation In Immature Female Rats Using Orthosteric And Allosteric Luteinizing Hormone Receptor Agonists / Doklady Rossijskoj akademii nauk. Nauki o žizni. – (2023). - Vol. 508. - N. 1. - P. 30-34. doi: 10.31857/S2686738922700032.
- Efremova M.М., Rumyantsev A.M., Babitova E.S., Ianshina T. M., Govd A.I. Synthesis of 5-ethynylisoxazoles based on 1,3-dipolar cycloaddition reactions of nitrile oxides with conjugated diynes. Russ. Chem. Bull. 2023, 72, 1717–1721. DOI: 10.1007/s11172-023-3952-5.
- T. Ianshina; A. Sidorin; K. Petrova; M. Shubert, A. Makeeva, E. Sambuk; A. Govdi, A. Rumyantsev, M. Padkina Effect of Methionineon Gene Expression in Komagataella phaffii Cells. Microorganisms. 2023, 11, 877. DOI: 10.3390/microorganisms11040877.
- S.G.Zlotin, K.S.Egorova, V.P.Ananikov, A.A.Akulov, M.V.Varaksin, O.N.Chupakhin, V.N.Charushin...., I.A.Balova, V.N.Sorokoumov et al. Russ. Chem. Rev., 2023, 92 (12) RCR5104.
- Derkach, K.V.; Lebedev, I.A.; Morina, I.Y.; Bakhtyukov, A.A.; Pechalnova, A.S.; Sorokoumov, V.N.; Kuznetsova, V.S.; Romanova, I.V.; Shpakov, A.O., Int. J. Mol. Sci., 24 (2023), 16618.
2022
- Danilkina, N.A.; Khmelevskaya, E.A.; Lyapunova, A.G.; D’yachenko, A.S.; Bunev, A.S.; Gasanov, R.E.; Gureev, M.A.; Balova, I.A. Functionalized 10-Membered Aza- and Oxaenediynes through the Nicholas Reaction. Molecules 2022, 27, 6071, doi: 10.3390/molecules27186071. Impact Factor: 4.927.
- Babushkina, A.A.; Mikhaylov, V.N.; Novikov, A.S.; Sorokoumov, V.N.; Gureev, M.A.; Kryukova, M.A.; Shpakov, A.O.; Balova, I.A. Synthesis , X-ray and DFT studies of 6-halo-3-(hydroxymethyl ) cinnolin-4(1H)-ones. Chem. Heterocycl. Compd. 2022, 58, 432–437, doi: 10.1007/s10593-022-03109-3. Impact Factor: 1.490.
- Govdi, A.I.; Tokareva, P.V.; Rumyantsev, A.M.; Panov, M.S.; Stellmacher, J.; Alexiev, U.; Danilkina, N.A.; Balova, I.A. 4,5-Bis(arylethynyl)-1,2,3-triazoles—A New Class of Fluorescent Labels: Synthesis and Applications. Molecules 2022, 27, doi: 10.3390/molecules27103191. Impact Factor: 4.927.
- Gholinejad, M.; Shojafar, M.; Sansano, J.M.; Mikhaylov, V.N.; Balova, I.A.; Khezri, R. Hyperbranched polymer immobilized palladium nanoparticles as an efficient and reusable catalyst for cyanation of aryl halides and reduction of nitroarenes. J. Organomet. Chem. 2022, 970–971, doi: 10.1016/j.jorganchem.2022.122359. Impact Factor: 2.345.
- Derkach, K. V; Fokina, E.A.; Bakhtyukov, A.A.; Sorokoumov, V.N.; Stepochkina, A.M.; Zakharova, I.O.; Shpakov, A.O. The Study of Biological Activity of a New Thieno[2,3-D]-Pyrimidine-Based Neutral Antagonist of Thyrotropin Receptor. Bull. Exp. Biol. Med. 2022, 172, 713–717, doi: 10.1007/s10517-022-05462-x. Impact Factor: 0.737.
- Bakhtyukov, A.A.; Derkach, K. V; Fokina, E.A.; Sorokoumov, V.N.; Zakharova, I.O.; Bayunova, L. V; Shpakov, A.O. Development of Low-Molecular-Weight Allosteric Agonist of Thyroid-Stimulating Hormone Receptor with Thyroidogenic Activity. Dokl. Biochem. Biophys. 2022, 503, 67–70, doi: 10.1134/S1607672922020016. Impact Factor: 0.834.
- Bakhtyukov, A.A.; Derkach, K. V; Sorokoumov, V.N.; Stepochkina, A.M.; Romanova, I. V; Morina, I.Y.; Zakharova, I.O.; Bayunova, L. V; Shpakov, A.O. The effects of separate and combined treatment of male rats with type 2 diabetes with metformin and orthosteric and allosteric agonists of luteinizing hormone receptor on steroidogenesis and spermatogenesis. Int. J. Mol. Sci. 2022, 23, doi: 10.3390/ijms23010198. Impact Factor: 6.208.
- Bakhtyukov, A.A.; Derkach, K.V.; Stepochkina, A.M.; Sorokoumov, V.N.; Bayunova, L.V.; Lebedev, I.A.; Shpakov, A.O. Effects of metformin and lutheinizing hormone receptor agonists on steroidogenesis and spermatogenesis in rats with type 2 diabetes with their separate and combined administration. Metabolism 2022, 128, 155010, doi: 10.1016/j.metabol.2021.155010. Impact Factor: 13.934.
- Bakhtyukov, A.A.; Morina, I.Y.; Derkach, K. V.; Romanova, I. V.; Sorokoumov, V.N.; Shpakov, A.O. Development of Approaches to Reducing the Effective Gonadotropin Dose in Treating Androgen Insufficiency in Male Rats with Type 1 Diabetes Mellitus. J. Evol. Biochem. Physiol. 2022, 58, 1503–1513, doi: 10.1134/S0022093022050209. Impact Factor: 1.621.
- Stepochkina, A.M.; Bakhtyukov, A.A.; Derkach, K. V.; Sorokoumov, V.N.; Shpakov, A.O. A Comparative Study of the Steroidogenic Effect of 5-Amino-N-tert-butyl-2-(methylthio)-4-(3-(nicotinamido)phenyl)thieno[2,3-d]-pyrimidine-6-carboxamide and Chorionic Gonadotropin with Different Methods of Administration to Male Rats. J. Evol. Biochem. Physiol. 2022, 58, 54–63, doi: 10.1134/S0022093022010057. Impact Factor: 1.621.
2021
- Mikhaylov, V.N.; Kazakov, I. V.; Parfeniuk, T.N.; Khoroshilova, O. V.; Scheer, M.; Timoshkin, A.Y.; Balova, I.A. The carbene transfer to strong Lewis acids: copper is better than silver. Dalt. Trans. 2021, 50, 2872–2879. doi: 10.1039/D1DT00235J.
- Efremova, M.M.; Govdi, A.I.; Frolova, V.V.; Rumyantsev, A.M.; Balova, I.A. Design and Synthesis of New 5-aryl-4-Arylethynyl-1H-1,2,3-triazoles with Valuable Photophysical and Biological Properties. Molecules. 2021, 26, 2801. doi: 10.3390/molecules26092801.
- V. N. Mikhaylov, I. A. Balova. Alternative Transformations of N-Heterocyclic Carbene Complexes of the Group 11 Metals in Transmetalation Reactions (A Review). Russian Journal of General Chemistry. 2021, Vol. 91, No. 11, pp. 2192–2246. DOI: 10.1134/S1070363221110098.
- Danilkina N.A., Govdi A.I., Khlebnikov A. F., Tikhomirov A.O. Sharoyko V. V., Shtyrov A. A., Ryazantsev M. N. Bräse S., Balova I. A. Heterocycloalkynes Fused to a Heterocyclic Core: Searching for an Island with Optimal Stability-Reactivity Balance. J. Am. Chem. Soc. 2021, 143, 16519–16537. doi: 10.1021/jacs.1c06041.
- Danilkina, N.A.; Andrievskaya, E.V.; Vasileva, A.V.; Lyapunova, A.G.; Rumyantsev, A.M.; Kuzmin, A.A.; Bessonova, E.A.; Balova, I.A. 4-Azidocinnoline—Cinnoline-4-amine Pair as a New Fluorogenic and Fluorochromic Environment-Sensitive Probe. Molecules. 2021, 26, 7460. doi: 10.3390/molecules26247460.
- A.A. Bakhtyukov, K.V. Derkach, I.V. Romanova, V.N. Sorokoumov, T.V. Sokolova, A.I. Govdi, I. Yu. Morina, A.A. Perminova, A.O. Shpakov. Effect of Low-Molecular-Weight Allosteric Agonists of the Luteinizing Hormone Receptor on Its Expression and Distribution in Rat Testes. J Evol Biochem Phys. 2021, 57, 208–220. doi: 10.1134/S0022093021020034.
- Bakhtyukov A.A., Derkach K.V., Stepochkina A.M., Sorokoumov V.N., Bayunova L.V., Lebedev I.A., Shpakov A.O. / The effect of metformin therapy on luteinizing hormone receptor agonists-induced stimulation of testosterone production and spermatogenesis in diabetic rats. J Evol Biochem Phys. 2021, V. 57. № 6. P. 1382–1393. doi: 10.1134/S002209302106017X.
- 12. Derkach, K.V., Romanova, I.V., Bakhtyukov, A.A., Morina, I.Y., Dar’in, D.V., Sorokoumov, V.N., Shpakov, A.O. / The Effect of Low-Molecular-Weight Allosteric Agonist of Luteinizing Hormone Receptor on Functional State of the Testes in Aging and Diabetic Rats. Bulletin of Experimental Biology and Medicine, 2021,171 (1), pp. 81-86. doi: 10.1007/s10517-021-05177-5.
2020
- Mikhaylov, V. N.; Pavlov, A. O.; Ogorodnov, Y. V; Spiridonova, D. V; Sorokoumov, V. N.; Balova, I. A. N-Propargylation and Copper(I)-Catalyzed Azide-Alkyne Cycloaddition as a Convenient Strategy for Directed Post-Synthetic Modification of 4-Oxo-1,4-Dihydrocinnoline Derivatives. Chem. Heterocycl. Compd. 2020, 56 (7), 915–922, doi: 10.1007/s10593-020-02750-0.
- Danilkina, N. A., D’yachenko, A., Govdi, A. I., Khlebnikov, A. F., Kornyakov, I., Bräse, S., & Balova, I. A. (2020). Intramolecular Nicholas Reactions in the Synthesis of Heteroenediynes fused to Indole, Triazole and Isocoumarin. The Journal of Organic Chemistry, doi: 10.1021/acs.joc.0c00930.
- Danilkina, N. A.; Govdi, A. I.; Balova, I. A. 5-Iodo-1H-1,2,3-triazoles as Versatile Building Blocks. Synthesis (Stuttg). 2020, 11–16, doi: 10.1055/s-0039-1690858.
- Danilkina, N. A.; Vasileva, A. A.; Balova, I. A. A.E.Favorskii’s scientific legacy in modern organic chemistry: prototropic acetyleneallene isomerization and the acetylene zipper reaction. Russ. Chem. Rev. 2020, 89, 125–171, doi: 10.1070/rcr4902.
- Mikhaylov, V. N.; Sorokoumov, V. N.; Novikov, A. S.; Melnik, M. V; Tskhovrebov, A. G.; Balova, I. A. Intramolecular hydrogen bonding stabilizes trans-configuration in a mixed carbene/isocyanide PdII complexes. J. Organomet. Chem. 2020, 121174, doi: 10.1016/j.jorganchem.2020.121174.
- Gordeychuk, D. I.; Sorokoumov, V. N.; Mikhaylov, V. N.; Panov, M. S.; Khairullina, E. M.; Melnik, M. V.; Kochemirovsky, V. A.; Balova, I. A. Copper-Based Nanocatalysts Produced via Laser-Induced Ex Situ Generation for Homo- and Cross-Coupling Reactions. Chem. Eng. Sci. 2020, 227, 115940. doi: 10.1016/j.ces.2020.115940.
2019
- Tskhovrebov, A. G.; Novikov, A. S.; Odintsova, O. V.; Mikhaylov, V. N.; Sorokoumov, V. N.; Serebryanskaya, T. V.; Starova, G. L. Supramolecular polymers derived from the PtII and PdII schiff base complexes via C(sp2)–H … Hal hydrogen bonding: Combined experimental and theoretical study. J. Organomet. Chem. 2019, 886, 71–75, doi: 10.1016/j.jorganchem.2019.01.023.
- Danilkina, N. A.; Bukhtiiarova, N. S.; Govdi, A. I.; Vasileva, A. A.; Rumyantsev, A. M.; Volkov, A. A.; Sharaev, N. I.; Povolotskiy, A. V.; Boyarskaya, I. A.; Kornyakov, I. V.; Tokareva, P. V.; Balova, I. A. Synthesis and Properties of 6-Aryl-4-azidocinnolines and 6-Aryl-4-(1,2,3-1H-triazol-1-yl)cinnolines. Molecules 2019, 24, 2386, doi: 10.3390/molecules24132386.
- Danilkina, N.; Rumyantsev, A.; Lyapunova, A.; D’yachenko, A.; Khlebnikov, A.; Balova, I. 10-Membered Azaenediyne Fused to a Benzothiophene through the Nicholas Macrocyclization: Synthesis and DNA Cleavage Ability. Synlett 2019, 30, 161–166. DOI: 10.1055/s-0037-1610352.
- Govdi, A. I.; Danilkina, N. A.; Ponomarev, A. V.; Balova, I. A. 1-Iodobuta-1,3-diynes in Copper-Catalyzed Azide–Alkyne Cycloaddition: A One-Step Route to 4-Ethynyl-5-iodo-1,2,3-triazoles. J. Org. Chem. 2019, 84, 1925–1940. DOI: 10.1021/acs.joc.8b02916.
2018
- Kulyashova, A. E.; Ponomarev, A. V.; Selivanov, S. I.; Khlebnikov, A. F.; Popik, V. V.; Balova, I. A. Cr(II)-promoted internal cyclization of acyclic enediynes fused to benzo[b]thiophene core: Macrocycles versus 2-methylenecycloalkan-1-ols formation. Arab. J. Chem. 2018. DOI: 10.1016/j.arabjc.2018.05.005.
- Mikhaylov, V.; Sorokoumov, V.; Liakhov, D.; Tskhovrebov, A.; Balova, I. Polystyrene-Supported Acyclic Diaminocarbene Palladium Complexes in Sonogashira Cross-Coupling: Stability vs. Catalytic Activity. Catalysts 2018, 8, 141. DOI: 10.3390/catal8040141.
- Tskhovrebov, A. G.; Vasileva, A. A.; Goddard, R.; Riedel, T.; Dyson, P. J.; Mikhaylov, V. N.; Serebryanskaya, T. V.; Sorokoumov, V. N.; Haukka, M. Palladium(II)-Stabilized Pyridine-2-Diazotates: Synthesis, Structural Characterization, and Cytotoxicity Studies. Inorg. Chem. 2018, 57, 930–934. DOI: 10.1021/acs.inorgchem.8b00072.
- Zakharova, I. O.; Sorokoumov, V. N.; Bayunova, L. V; Derkach, K. V; Shpakov, A. O. 4-oxo-1,4-dihydrocinnoline Derivative with Phosphatase 1B Inhibitor Activity Enhances Leptin Signal Transduction in Hypothalamic Neurons. J. Evol. Biochem. Physiol. 2018, 54, 273–280. DOI: 10.1134/S0022093018040038.
- Konovalov, A. I.; Antipin, I. S.; Burilov, V. A.; Madzhidov, T. I.; Kurbangalieva, A. R.; Nemtarev, A. V.; Solovieva, S. E.; Stoikov, I. I.; Mamedov, V. A.; Zakharova, L. Y.; Gavrilova, E. L.; Sinyashin, O. G.; Balova, I. A.; Vasilyev, A. V.; Zenkevich, I. G.; Krasavin, M. Y.; Kuznetsov, M. A.; Molchanov, A. P.; Novikov, M. S.; Nikolaev, V. A.; Rodina, L. L.; Khlebnikov, A. F.; Beletskaya, I. P.; Vatsadze, S. Z.; Gromov, S. P.; Zyk, N. V.; Lebedev, A. T.; Lemenovskii, D. A.; Petrosyan, V. S.; Nenaidenko, V. G.; Negrebetskii, V. V.; Baukov, Y. I.; Shmigol’, T. A.; Korlyukov, A. A.; Tikhomirov, A. S.; Shchekotikhin, A. E.; Traven’, V. F.; Voskresenskii, L. G.; Zubkov, F. I.; Golubchikov, O. A.; Semeikin, A. S.; Berezin, D. B.; Stuzhin, P. A.; Filimonov, V. D.; Krasnokutskaya, E. A.; Fedorov, A. Y.; Nyuchev, A. V.; Orlov, V. Y.; Begunov, R. S.; Rusakov, A. I.; Kolobov, A. V.; Kofanov, E. R.; Fedotova, O. V.; Egorova, A. Y.; Charushin, V. N.; Chupakhin, O. N.; Klimochkin, Y. N.; Osyanin, V. A.; Reznikov, A. N.; Fisyuk, A. S.; Sagitullina, G. P.; Aksenov, A. V.; Aksenov, N. A.; Grachev, M. K.; Maslennikova, V. I.; Koroteev, M. P.; Brel’, A. K.; Lisina, S. V.; Medvedeva, S. M.; Shikhaliev, K. S.; Suboch, G. A.; Tovbis, M. S.; Mironovich, L. M.; Ivanov, S. M.; Kurbatov, S. V.; Kletskii, M. E.; Burov, O. N.; Kobrakov, K. I.; Kuznetsov, D. N. Modern Trends of Organic Chemistry in Russian Universities. Russ. J. Org. Chem. 2018, 54, 157–371. DOI: 10.1134/S107042801802001X.
- Lyapunova, A. G.; Danilkina, N. A.; Rumyantsev, A. M.; Khlebnikov, A. F.; Chislov, M. V.; Starova, G. L.; Sambuk, E. V.; Govdi, A. I.; Bräse, S.; Balova, I. A. Relative Reactivity of Benzothiophene-Fused Enediynes in the Bergman Cyclization. J. Org. Chem. 2018, 83, 2788–2801. DOI: 10.1021/acs.joc.7b03258.
2017
- Shpakova, E. A.; Sorokoumov, V. N.; Akent’ev, A. V.; Derkach, K. V.; Tennikova, T. B.; Shpakov, A. O. The relationship between micelle formation and biological activity of peptide 562–572 of luteinizing hormone receptor modified with decanoyl radicals. Cell tissue biol. 2017, 11, 227–233. DOI: 10.1134/S1990519X17030105.
- Sorokoumov, V. N.; Shpakov, A. O. Protein phosphotyrosine phosphatase 1B: Structure, function, role in the development of metabolic disorders and their correction by the enzyme inhibitors. J. Evol. Biochem. Physiol. 2017, 53, 259–270. DOI: 10.1134/S0022093017040020.
- Gordeychuk, D. Vladimir Kochemirovsky, Victor Sorokoumov, Ilya Tumkin, Alexey Kuzmin, Irina Balova. Copper Particles Generated During in situ Laser-induced Synthesis Exhibit Catalytic Activity Towards Formation of Gas Phase. J. Laser Micro/Nanoengineering 2017, 12, 57–61. DOI: 10.2961/jlmn.2017.02.0001.
- Mikhaylov, V. N.; Sorokoumov, V. N.; Balova, I. A. Polystyrene-supported diaminocarbene complexes of palladium(II): synthesis, characterization and application as a precatalyst in Sonogashira–Hagihara and Suzuki–Miyaura cross coupling. Russ. Chem. Rev. 2017, 86, 459–473. DOI: 10.1070/RCR4715.
- Lyapunova, A. G.; D’yachenko, A. S.; Danilkina, N. A. Potassium fluoride for one-pot desilylation and the Sonogashira coupling of ethynylsilanes and buta-1,3-diynylsilanes. Russ. J. Org. Chem. 2017, 53, 800–804. DOI: 10.1134/S1070428017050268.
- Govdi, A. I.; Kulyashova, A. E.; Vasilevsky, S. F.; Balova, I. A. Functionalized buta-1,3-diynyl-N-methylpyrazoles by sequential “diacetylene zipper” and Sonogashira coupling reactions. Tetrahedron Lett. 2017, 58, 762–765. DOI: 10.1016/j.tetlet.2017.01.032.
2016
- Danilkina, N. A.; Gurskaya, L. Y.; Vasilyev, A. V; Balova, I. A. Towards Isocoumarin-Fused Enediyne Systems through the Electrophilic Cyclization of Methyl o-(Buta-1,3-diynyl)benzoates. European J. Org. Chem. 2016, 739–747. DOI: 10.1002/ejoc.201501262.
- Lyapunova, A. G.; Danilkina, N. A.; Khlebnikov, A. F.; Köberle, B.; Bräse, S.; Balova, I. A. Oxaenediynes through the Nicholas-Type Macrocyclization Approach. European J. Org. Chem. 2016, 2016, 4842–4851. DOI: 10.1002/ejoc.201600767.
- Mikhaylov, V. N.; Sorokoumov, V. N.; Korvinson, K. A.; Novikov, A. S.; Balova, I. A. Synthesis and Simple Immobilization of Palladium(II) Acyclic Diaminocarbene Complexes on Polystyrene Support as Efficient Catalysts for Sonogashira and Suzuki–Miyaura Cross-Coupling. Organometallics 2016, 35, 1684–1697. DOI: 10.1021/acs.organomet.6b00144.
- Mikhailov, V. N.; Korvinson, K.; Sorokoumov, V. N. Chiral acyclic diaminocarbene complexes of palladium(II) immobilized on a polymeric support as promising catalysts of the Suzuki reaction. Russ. J. Gen. Chem. 2016, 86, 2473–2476. DOI: 10.1134/S1070363216110128.
2009–2015
- Danilkina, N. A.; Vlasov, P. S.; Vodianik, S. M.; Kruchinin, A. A.; Vlasov, Y. G.; Balova, I. A. Synthesis and chemosensing properties of cinnoline-containing poly(arylene ethynylene)s. Beilstein J. Org. Chem. 2015, 11, 373–384. DOI: 10.3762/bjoc.11.43.
- Danilkina, N. A.; Lyapunova, A. G.; Khlebnikov, A. F.; Starova, G. L.; Bräse, S.; Balova, I. A. Ring-Closing Metathesis of Co2(CO)6–Alkyne Complexes for the Synthesis of 11-Membered Dienediynes: Overcoming Thermodynamic Barriers. J. Org. Chem. 2015, 80, 5546–5555. DOI: 10.1021/acs.joc.5b00409.
- Kulyashova, A. E.; Mikheeva, E. V.; Danilkina, N. A.; Balova, I. A. Synthesis of 2-(buta-1,3-diynyl)-N,N-dimethylanilines Using Reductive Methylation Step. Mendeleev Commun. 2014, 24, 102–104. DOI: 10.1016/j.mencom.2014.03.013.
- Danilkina, N. A.; Kulyashova, A. E.; Khlebnikov, A. F.; Bräse, S.; Balova, I. A. Electrophilic Cyclization of Aryldiacetylenes in the Synthesis of Functionalized Enediynes Fused to a Heterocyclic Core. J. Org. Chem. 2014, 79, 9018–9045. DOI: 10.1021/jo501396s.
- Mikhailov, V. N.; Savicheva, E. A.; Sorokoumov, V. N.; Boyarskii, V. P. Catalytic activity of palladium(II) diaminocarbene complexes in the Sonogashira and Suzuki reactions. Russ. J. Org. Chem. 2013, 49, 551–554. DOI: 10.1134/S107042801304009X.
- Ryabukhin, D. S.; Sorokoumov, V. N.; Savicheva, E. A.; Boyarskiy, V. P.; Balova, I. A.; Vasilyev, A. V. Catalytic activity of palladium acyclic diaminocarbene complexes in the synthesis of 1,3-diarylpropynones via Sonogashira reaction: cross- versus homo-coupling. Tetrahedron Lett. 2013, 54, 2369–2372. DOI: 10.1016/j.tetlet.2013.02.086.
- Kulyashova, A. E.; Sorokoumov, V. N.; Popik, V. V; Balova, I. A. An acetylene zipper—Sonogashira reaction sequence for the efficient synthesis of conjugated arylalkadiynols. Tetrahedron Lett. 2013, 54, 2235–2238. DOI: 10.1016/j.tetlet.2013.02.066.
- Danilkina, N. A.; Kulyashova, A. E.; Balova, I. A. Intramolecular cyclizations of functionalized diynes. Chem. Heterocycl. Compd. 2012, 48, 95–106. DOI: 10.1007/s10593-012-0973-7.
- Danilkina, N.; Nieger, M.; Selivanov, S.; Bräse, S.; Balova, I. Electrophilic Cyclization and Ring-Closing Metathesis as Key Steps in the Synthesis of a 12-Membered Cyclic Enediyne. European J. Org. Chem. 2012, 2012, 5660–5664. DOI: 10.1002/ejoc.201200881.
- Danilkina, N. A.; Gorbunova, E. G.; Sorokoumov, V. N.; Balova, I. A. Study of cyclyzation of o-(1-Alkynyl)- and o-(1,3-Butadiynyl)aryltriazenes under the action of acids. Russ. J. Org. Chem. 2012, 48, 1424–1434. DOI: 10.1134/S1070428012110048.
- Danilkina, N. A.; Mikhaylov, L. E.; Ivin, B. A. Reaction of acetylenedicarboxylic acids esters with 4,5-dihydro-1H-pyrazole-1-carbothioamides and 3,4,5,6-tetrahydro-2H-1,2,4-triazepine-3-thiones. Chem. Heterocycl. Compd. 2011, 47, 886–900. DOI: 10.1007/s10593-011-0850-9.
- Novikov, R. V.; Danilkina, N. A.; Balova, I. A. Cyclocondensation of n-(prop-2-yn-1-yl)- and n-(penta-2,4-diyn-1-yl)- o-phenylenediamines with phenyl isothiocyanate and carbon disulfide. Chem. Heterocycl. Compd. 2011, 47, 758–766. DOI: 10.1007/s10593-011-0831-z.
- Sorokoumov, V. N.; Popik, V. V.; Balova, I. A. Access to 2,3-bis(buta-1,3-diynyl)pyridines. Mendeleev Commun. 2011, 21, 19–20. DOI: 10.1016/j.mencom.2011.01.008.
- Tskhovrebov, A. G.; Luzyanin, K. V.; Kuznetsov, M. L.; Sorokoumov, V. N.; Balova, I. A.; Haukka, M.; Kukushkin, V. Y. Substituent R-Dependent Regioselectivity Switch in Nucleophilic Addition of N-Phenylbenzamidine to PdII- and PtII-Complexed Isonitrile RN≡C Giving Aminocarbene-Like Species. Organometallics 2011, 30, 863–874. DOI: 10.1021/om101041g.
- Danilkina, N.; Bräse, S.; Balova, I. Electrophilic Cyclization of Buta-1,3-diynylarenes: Synthesis of Precursors of (Z)-3-Ene-1,5-diyne Systems Fused to Heterocycles. Synlett 2011, 2011, 517–520. DOI: 10.1055/s-0030-1259547.
- Vinogradova, O. V.; Sorokoumov, V. N.; Balova, I. A. A short route to 3-alkynyl-4-bromo(chloro)cinnolines by Richter-type cyclization of ortho-(dodeca-1,3-diynyl)aryltriaz-1-enes. Tetrahedron Lett. 2009, 50, 6358–6360. DOI: 10.1016/j.tetlet.2009.08.103.
СМИ о нас
- КНВШ Санкт-Петербурга
- Energyland.info
- Новости нанотехнологий
- Научная Россия
- Science News
- Красная весна
- Московский Комсомолец - Санкт-Петербург
- AllNW.ru
- 7ooo
- Russia24.pro
- Фотопарацци
- Seldon.News
- Day time news
- Day time news
- Smi.Today
- Seldon.News
- БезФормата - г. Санкт-Петербург
- БезФормата - г. Санкт-Петербург
- Новости СПбГУ: лаборатория ацетиленовой химии СПбГУ (2021 год)




